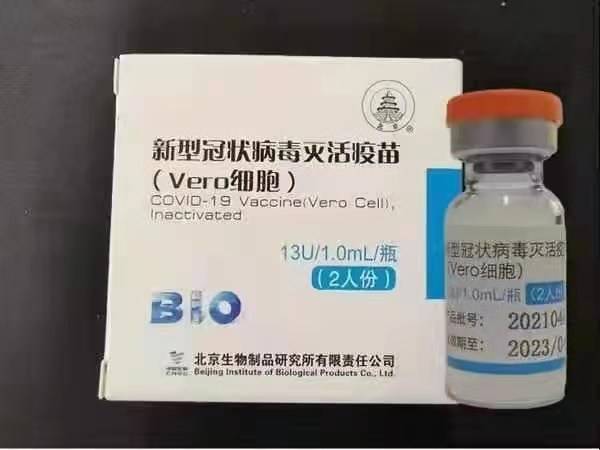
シノファーム(北京):BBIBP-CorV
フェーズ1
1トライアル
ChiCTR2000032459
中国
フェーズ2
2回の試行
NCT04962906
アルゼンチン
ChiCTR2000032459
中国
フェーズ3
6回の試行
NCT04984408
ChiCTR2000034780
アラブ首長国連邦
NCT04612972
ペルー
NCT04510207
バーレーン、エジプト、ヨルダン、アラブ首長国連邦
NCT04560881、BIBP2020003AR
アルゼンチン
NCT04917523
アラブ首長国連邦
承認
WHO緊急使用リスト 59カ国
アンゴラ、アルゼンチン、バーレーン、バングラデシュ、ベラルス、ベリーズ、ボリビア(多国籍州)、ブラジル、ブルネイダルサラーム、カンボジア、カメルーン、チャド、中国、コモロ、エジプト、赤道ギニア、ガボン、ガンビア、ジョージア、グヤナ、ハンガリー、イラン(イスラム共和国)、イラク、ヨルダン、キルギスタン、ラオス人民民主共和国
レバノン、マレーシア、モルディブ、モルディブ、アウリティウス、モンゴル、モンテネグロ、モロッコ、モザンビーク、ナミビア、ネパール、ニジェール、北マケドニア、パキスタン、パラグアイ、ペルー、フィリピン、コンゴ共和国、エネガル、セルビア、セイシェル、シエラレオーネ諸島、ソマリア、スリランカ、タイ、トリニダードとトバゴ、チュニジア、アラブ首長国連邦、ベネズエラ(ボリバル共和国)、ベトナム、ジンバブエ
Sinopharm BBIBP-CorV COVID-19は、病原性を欠く培養増殖ウイルス粒子から作られた不活化ワクチンです。このワクチン候補は、SinopharmHoldingsとBeijingInstitute of BiologicalProductsによって開発されました。
Sinopharm BBIBP-CorVワクチンは、免疫系がSARS-CoV-2ベータコロナウイルスに対する抗体を産生できるようにすることで機能します。狂犬病ワクチンやA型肝炎ワクチンなどの不活化ウイルスワクチンは、何十年にもわたって使用されてきました。この開発技術は、狂犬病ワクチンなど、多くの有名なワクチンにうまく適用されています。
SinopharmのSARS-CoV-2株(WIV04株およびライブラリ番号MN996528)は、中国の武漢にあるJinyintan病院の患者から分離されました。ウイルスは有能なベロ細胞株の培養で増殖し、感染細胞の上清をβ-プロピオラクトン(1:4000 vol / vol、2〜8°C)で48時間不活化しました。細胞破片の清澄化と限外濾過の後、最初の不活化と同じ条件下で2回目のβ-プロピオラクトン不活化を行った。WHOによると、ワクチンは0.5 mgのミョウバンに吸着され、防腐剤を含まない0.5mLの滅菌リン酸緩衝生理食塩水中のプレフィルドシリンジにロードされました。
2020年12月31日、国家医薬品局はSinopharmによって開発された実験用ワクチンの承認を発表しました。
2021年5月7日、世界保健機関はワクチンの承認を発表しました。WHOの緊急使用リストにより、各国はCOVID-19ワクチンの輸入と投与に関する独自の規制当局の承認を迅速に行うことができました。免疫化戦略に関するWHO諮問専門家グループもワクチンのレビューを完了しました。入手可能なすべての証拠に基づいて、WHOは、18歳以上の成人に対して、3〜4週間間隔で2回のワクチン接種を推奨しています。症候性疾患および入院疾患に対するワクチン有効性は、すべての年齢層を合わせて79%と推定されています。
American Medical Associationは、2021年5月26日に「ランダム化臨床試験:成人の症候性COVID-19感染に対する2つの不活化SARS-CoV-2ワクチンの効果」を発表し、「ランダム化臨床試験のこの事前に指定された中間分析では、成人ランダム化臨床試験のこの事前に指定された中間分析で投与された2つの不活化SARS-CoV-2ワクチンは、症候性COVID-19のリスクを大幅に低減し、重篤な有害事象はまれでした。」成人を対象としたこの第3相ランダム化試験では、症候性COVID-19症例における2つの不活化全ウイルスワクチンの有効性はそれぞれ72.8%と78.1%でした。2つのワクチンは、ミョウバンのみの対照群と同様の頻度でまれな重篤な有害事象を示し、ほとんどがワクチン接種とは無関係でした。探索的分析により、2つのワクチンが第1/2相試験の結果と同様に測定可能な中和抗体を誘導することがわかりました。
WHO SAGEワーキンググループは、2021年5月10日にSinopharm / BBIBP COVID-19ワクチンのレビューを発表しました。GAVIのCOVID-19ワクチンには、ワクチンが適切に保管され、曝露されていないかどうかを医療従事者に知らせるワクチンバイアルモニターが組み込まれています。過熱。その結果、損傷、GAVIは2021年5月14日に報告しました。ZebraTechnologiesとTemptime Corporationが製造したスマートラベルは、時間の経過とともに不可逆的に発色する無色の化学物質でできた、中央に明るい色の正方形が付いた円で構成されています。 。これは暗くなり、累積的な熱暴露を視覚的に示します。バイアルが最適な保管範囲を超えて熱にさらされると、正方形は円よりも暗くなり、ワクチンを使用しないことを示します。
National Drug BBIBP-CorV COVID-19ワクチン医薬品ライブラリ登録番号:DB15807。